论文Detecting structural heart disease from electrocardiograms using AI的研究采用AI,利用心电图(ECG)检测结构性心脏病(Structural Heart Disease, SHD)。论文提出了EchoNext模型,该模型代表了一种将AI技术嵌入心血管筛查流程的重要进展,有望显著提升结构性心脏病的早期发现率,尤其在医疗资源有限或未普遍使用心超的地区具有巨大潜力。
论文作者为Timothy J. Poterucha, Linyuan Jing, Ramon Pimentel Ricart, Michael Adjei-Mosi, Joshua Finer, Dustin Hartzel, Christopher Kelsey, Aaron Long, Daniel Rocha, Jeffrey A. Ruhl, David vanMaanen, Marc A. Probst, Brock Daniels, Shalmali D. Joshi, Olivier Tastet, Denis Corbin, Robert Avram, Joshua P. Barrios, Geoffrey H. Tison, I-Min Chiu, David Ouyang, Alexander Volodarskiy, Michelle Castillo, Francisco A. Roedan Oliver, Paloma P. Malta, Siqin Ye, Gregg F. Rosner, Jose M. Dizon, Shah R. Ali, Qi Liu, Corey K. Bradley, Prashant Vaishnava, Carol A. Waksmonski, Ersilia M. DeFilippis, Vratika Agarwal, Mark Lebehn, Polydoros N. Kampaktsis, Sofia Shames, Ashley N. Beecy, Deepa Kumaraiah, Shunichi Homma, Allan Schwartz, Rebecca T. Hahn, Martin Leon, Andrew J. Einstein, Mathew S. Maurer, Heidi S. Hartman, John Weston Hughes, Christopher M. Haggerty & Pierre Elias,来自多家机构:Seymour, Paul, and Gloria Milstein Division of Cardiology, Department of Medicine, Columbia University Irving Medical Center, New York, NY, USA. NewYork-Presbyterian Hospital, New York, NY, USA. Columbia University Vagelos College of Physicians and Surgeons, New York, NY, USA. Department of Biomedical Informatics, Columbia University, New York, NY, USA. Department of Emergency Medicine, Columbia University Irving Medical Center, New York, NY, USA. Departments of Emergency Medicine and Population Health Sciences, Weill Cornell Medicine, New York, NY, USA. Division of Cardiology, Montreal Heart Institute, Montreal, Quebec, Canada. Division of Cardiology and Bakar Computational Health Sciences Institute, University of California, San Francisco, San Francisco, CA, USA. Division of Cardiology, Cedars Sinai, Los Angeles, CA, USA. Department of Emergency Medicine, Kaohsiung Chang Gung Memorial Hospital, Kaohsiung, Taiwan. Division of Cardiology, NewYork-Presbyterian Hospital-Queens, New York, NY, USA. Division of Cardiology, Department of Medicine, Weill Cornell Medicine, New York, NY, USA.
Cardiovascular Research Foundation, New York, NY, USA. 14Department of Radiology, Columbia University Irving Medical Center, New York, NY, USA.
一、研究背景与动机
SHD是一类影响心脏瓣膜、心室壁、心腔等结构的疾病,包括心力衰竭、心室肥厚、肺动脉高压、心包积液以及各类中重度心瓣膜病。该类疾病患病率高、危害大,但由于影像学工具(如超声心动图)昂贵、需专业操作,限制了广泛筛查,导致大量患者被漏诊。尽管近年来深度学习模型在从ECG识别特定心脏病(如低左心室射血分数LVEF或主动脉瓣狭窄)上表现出色,但此前方法多聚焦于单一疾病或特定人群,泛化性和可拓展性有限。因此,作者提出使用AI模型从常规12导联心电图中检测多种SHD,提高早筛能力、降低成本,并促进AI在临床筛查中的应用。
二、模型设计与数据集构建
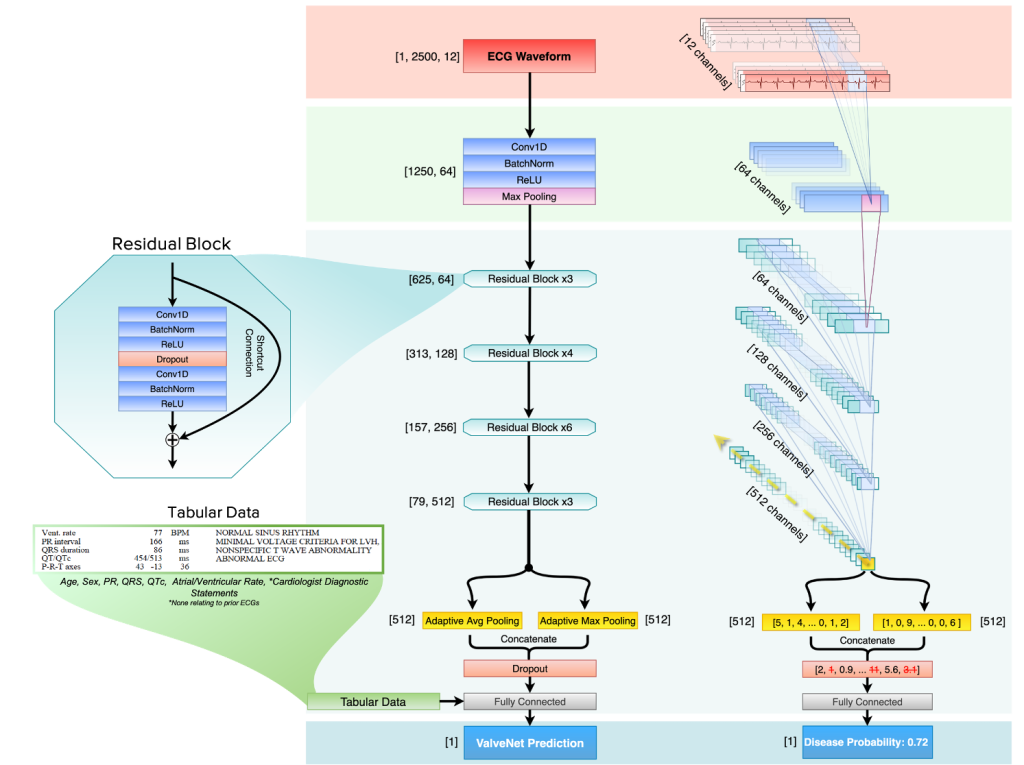
本研究提出的模型命名为 EchoNext,其基础为卷积神经网络(CNN),训练数据来自纽约长老会医院系统(NYP)8家附属医院,时间跨度为2008–2022年,总计1,245,273对ECG–超声心动图配对数据,涵盖230,318名年龄≥18岁的患者。数据按患者划分为训练集(149,819人)、验证集(35,780人)和测试集(44,719人)。疾病标注依据美国和欧洲心脏病协会的超声心动图指南定义,包括LVEF≤45%、左心室壁厚≥1.3cm、中重度右心室功能障碍、肺动脉高压、中重度各类瓣膜反流/狭窄或中大量心包积液等。训练中将ECG时间限定在距心超检查前1年内,确保标签可靠性。
模型结构中采用了残差网络(ResNet)Block。
三、多任务学习与模型性能
EchoNext不仅学习复合SHD标签,还以多任务分类形式输出每一疾病子项预测结果,以应对标签间共线性(如肺动脉反流与三尖瓣反流关联)。在内部NYP测试集上,模型AUC为85.2%,AUPRC为78.5%,诊断比值比为12.8。在单项疾病检测中,对低LVEF(AUC 90.4%)、右心室功能障碍(AUC 90.8%)预测效果最佳;对左室壁厚异常、肺动脉反流、心包积液等相对较差(AUC均在77–80%左右)。模型在各年龄、性别、种族群体中均表现稳定,尤其在年轻人群中AUC略高。训练数据在不同子医院(如CUIMC、Brooklyn Methodist等)之间划分训练/测试后,也能保持模型性能一致性,说明模型具有良好的泛化能力。
四、外部验证与临床部署
作者在三个独立医学中心(Cedars-Sinai, Montreal Heart Institute 和 UCSF)对EchoNext进行了外部验证,样本总数超过27,000人,SHD患病率高达46%-54%。尽管AUC略下降至78%-80%,但AUPRC保持在77%-80%之间,表现依然可接受。这种表现下降主要归因于不同人群的特征差异(年龄结构、疾病谱等)及SHD患病率的差异。此外,在一项“静默部署”(silent deployment)实验中,模型被用在未做过心超的84,875名新患者的124,000余条ECG上,预测高风险者中,后续做心超发现38%确诊SHD,说明模型具备真实场景下的早筛能力。
五、对比心脏病专家与AI辅助效果
研究通过抽取150份ECG并邀请13位资深心脏病学家进行人工判断,同时比较了AI模型单独预测、人工预测和AI辅助预测三种情况。在不使用AI协助时,医生的平均准确率为64%,而EchoNext模型为77.3%;在提供AI得分后,医生准确率提高至69.2%,但仍低于AI模型本身。尤其在心电图正常与异常情况下,AI模型表现稳定,而医生则更易受ECG是否异常影响。这进一步说明AI可作为医生决策的有力补充,特别是在缺乏影像或症状线索的早期检测阶段。
六、前瞻性临床试验DISCOVERY
为了验证AI模型在真实临床中的应用价值,研究团队进行了一个100人规模的前瞻性临床试验DISCOVERY,采用早期版本模型ValveNet进行风险分层招募,从未做过心超的患者中选取高风险和中风险人群接受心超检查。结果显示高风险组中有53%被确诊为SHD,24%确诊左侧瓣膜病(主要是主动脉或二尖瓣狭窄/反流),而中风险组中仅19%和2%。回溯性地使用升级版EchoNext在这100例数据上再评估,预测准确性进一步提升。这表明AI预测不仅能指导高效筛查,也具备对不同风险层级进行差异化管理的潜力。
七、Columbia公开数据集与模型发布
为了促进AI-ECG研究标准化与可比性,研究团队开放了一个名为“Columbia mini-model”的数据集与模型,包含来自哥伦比亚大学医学院的100,000份ECG与配对超声标签,涵盖36,286位患者。该数据集按照标准规范去标识化处理,保留了ECG波形、人口统计信息和所有超声标签。使用这套数据训练的Columbia mini-model在本地测试集上AUC达到82.0%,性能接近EchoNext(83.1%),为今后相关AI模型的训练和评估提供了宝贵基准资源。
八、讨论与临床意义
本研究表明,AI模型能够从ECG中准确识别包括LVEF降低、心室肥厚、各类瓣膜病等在内的结构性心脏病,且在多机构、多种族、多场景中具有良好泛化性与稳定性。模型性能优于临床医生的人工判断,即使提供AI评分作为参考,医生的判断准确率也未超过模型自身。研究提出了将AI模型用于“安全网筛查”或“临床门槛判断”的两种部署策略,前者用于扩大筛查覆盖,后者用于避免过度检查。本文也指出AI辅助诊断仍需处理医生信任度、误报引发焦虑、标签主观性等问题,同时强调应持续开展大规模前瞻性研究,评估其临床实际价值和成本效益。
九、局限性与未来展望
作者承认模型训练中使用的标签多为二值化结果,存在人为设定阈值的主观性;一些疾病(如肺动脉反流)样本稀缺或标注噪声大,导致模型性能有限;多任务训练下对部分标签的优化可能被牺牲以提升整体性能。此外,DISCOVERY试验样本较小,且早期模型仅覆盖左侧瓣膜病,需更多大型、实际临床流程嵌入的验证研究。同时,未来模型可进一步发展为多模态、多时序系统,结合影像、实验室数据等实现更全面、动态的个体风险评估。
论文相关代码:https://github.com/PierreElias/IntroECG